Glasübergang
Die Glas-Flüssigkeits-Übergang oder eine Glasübergangs kurz ist der reversible Übergang in amorphen Materialien (oder in amorphen Regionen innerhalb semikristallinen Materialien) von einem harten und relativ spröden „glasigen“ Zustand in einen viskosen oder gummiartigen Zustand, wenn die Temperatur erhöht wird. [1] Ein amorpher Feststoff, der eine Glasübergangs zeigt, wird ein Glas genannt. Der umgekehrte Übergang erreicht, indem eine viskose Flüssigkeit in den Glaszustand Unterkühlung wird Vitrifikation bezeichnet.
Die Glasübergangs temperatureTg ein Material charakterisiert den Temperaturbereich, über die dieser Glasübergang auftritt. Es ist immer niedriger als die Schmelztemperatur. Tm. des kristallinen Zustand des Materials, falls vorhanden.
Harte Kunststoffe wie Polystyrol und Poly (methylmethacrylat) verwendet werden, gut unterhalb ihrer Glasübergangstemperaturen, ist, dass in ihrem glasigen Zustand. Ihr Tg-Wert liegt deutlich über Raumtemperatur, jeweils bei etwa 100 ° C (212 ° F). Gummi-Elastomere wie Polyisopren und Polyisobutylen oberhalb ihrer Tg verwendet. das heißt, in dem gummiartigen Zustand, wo sie sind weich und flexibel. [2]
Trotz der Änderung der physikalischen Eigenschaften eines Materials durch seinen Glasübergang, wird der Übergang nicht einen Phasenübergang betrachtet; vielmehr ist es ein Phänomen, einen Bereich von Temperatur und definiert durch eine von mehreren Übereinkommen erstreckt. [3] [4] Ein solche Konventionen umfassen eine konstante Kühlrate (20 Kelvin pro Minute (36 ° F / min)) [1] und eine Viskosität Schwelle von 10 12 Pa · s. unter anderen. Beim Abkühlen oder Erhitzen durch diesen Glasübergangsbereich, das Material weist auch einen glatten Schritt in dem thermischen Ausdehnungskoeffizienten und in der spezifischen Wärme. mit der Lage dieser Effekte wieder auf der Geschichte des Materials abhängt. [5] Die Frage, ob einiger Phasenübergang liegt unter der Glasübergangs ist eine Frage der Forschung fortzusetzen. [3] [4] [6]
Die Konfiguration des Glases in diesem Temperaturbereich ändert sich mit der Zeit langsam in Richtung der Gleichgewichtsstruktur. Das Prinzip der Minimierung der Gibbs-Energie liefert die thermodynamische Antriebskraft, die für die eventuelle Änderung. Es sei hier darauf hingewiesen, dass bei etwas höheren Temperaturen als Tg. die Struktur bei einer beliebigen Temperatur bis zum Gleichgewicht entspricht, wird sehr schnell erreicht. Im Gegensatz dazu bei deutlich niedrigeren Temperaturen bleibt die Konfiguration des Glases vernünftig stabil über zunehmend längere Zeiträume.
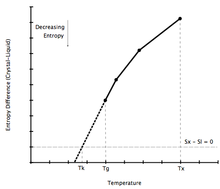
Entropy Differenz zwischen Kristall und unterkühlten Schmelze
Wenn eine Flüssigkeit unterhalb seiner Kauzmann Temperatur kühlten werden kann, und es hat in der Tat eine geringere Entropie als die Kristallphase angezeigt werden, wären die Folgen paradox. Dieses Kauzmann Paradox Gegenstand vieler Diskussionen und viele Publikationen hat sich seit der ersten von Walter Kauzmann im Jahr 1948. [31] vorgelegt wurde
Der Glasübergang in spezifischen Materialien bearbeiten
Siliciumdioxid, SiO2 bearbeiten
Silica (die chemische Verbindung SiO2) eine Anzahl von unterschiedlichen Kristallformen neben der Quarzstruktur. Fast alle der kristallinen Formen beinhalten tetraedrischen SiO 4 Einheiten miteinander verbunden durch gemeinsame Eckpunkte in verschiedenen Anordnungen. Si-O-Bindungslängen variieren zwischen den verschiedenen Kristallformen. Beispielsweise in α-Quarz ist die Bindungslänge 161 Pikometer (6,3 × 10 -9 in), wohingegen in α-Tridymit es 154 bis 171 pm liegt im Bereich (6,1 × 10 -9 -6.7 × 10 -9 in). Der Si-O-Si-Bindungswinkel variiert auch von 140 ° in α-Tridymit bis 144 ° in α-Quarz auf 180 ° in β-Tridymit. Abweichungen von diesen Standardparametern bilden mikrostrukturelle Unterschiede oder Variationen, die einen Ansatz zu einem amorphen darstellen. glasigen oder glasartiger Feststoff. Die Übergangstemperatur Tg in Silikaten wird auf die energiebezogenen erforderlich zu brechen und Wieder Form kovalenter Bindungen in einem amorphen (oder zufälligen Netzwerk) Gitter von kovalenten Bindungen. Die Tg wird deutlich durch die Chemie des Glases beeinflusst. Zum Beispiel kann die Zugabe von Elementen wie B. Na. K oder Ca zu einem Quarzglas. die eine Wertigkeit von weniger als 4, hilft in der Netzwerkstruktur Zerschlagung, wodurch die Tg zu reduzieren. Alternativ P., die eine Wertigkeit von 5 hat, hilft, ein geordnetes Gitter zu verstärken, und somit erhöht sich die Tg. [32]
Tg ist direkt proportional zur Bindungsstärke, z.B. es hängt von Quasi-Gleichgewichtsthermodynamischen Parameter der Bindungen z.B. auf der Enthalpie und Entropie Hd Sd von configurons - gebrochenen Bindungen: Tg = Hd / [+ Sd Rln [(1-fc) / fc] wobei R die Gaskonstante ist und fc die Perkolationsschwelle. Für starke Schmelzen wie SiO2 in der obigen Gleichung die Perkolationsschwelle ist die universelle Scher-Zallen kritische Dichte in dem 3-D-Raum z.B. fc = 0,15, jedoch für das zerbrechlichen Materialien Perkolationsschwellen ist materialabhängig und fc << 1. [33] The enthalpy Hd and the entropy Sd of configurons – broken bonds can be found from available experimental data on viscosity. [34]

In Bügeln, ist ein Gewebe durch den Glas-Gummi-Übergang erhitzt.
Polymere bearbeiten
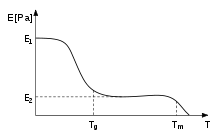
Steifigkeit gegenüber der Temperatur
In viskoelastischen Materialien hängt das Vorhandensein von Flüssigkeit ähnlicher Verhalten auf den Eigenschaften und variiert so mit Rate der aufgebrachten Last, das heißt, wie schnell eine Kraft ausgeübt wird. Das Silikon Spielzeug Silly Putty Ganz anders verhält sich in Abhängigkeit von der Zeitrate einer Kraft des Aufbringens: Ziehen langsam und es fließt, als eine stark viskose Flüssigkeit wirkt; trifft es mit einem Hammer und es zerbricht, als ein Glas wirkt.
Beim Abkühlen Gummi erfährt eine flüssigkeitsGlasÜberGang. die auch einen Gummi-Glasübergang genannt.
Mechanik der Vitrifikation bearbeiten
Die Unzulänglichkeiten dieser Schlussfolgerung wurden jedoch von Frenkel in seiner Revision der kinetischen Theorie der Feststoffe und der Elastizitätstheorie in Flüssigkeiten aufgezeigt. Diese Änderung ergibt sich unmittelbar aus der kontinuierlichen Kennlinie des strukturellen Übergang aus dem flüssigen Zustand in den festen eins, wenn dieser Übergang nicht durch Kristallisation-ergo die unterkühlte, viskose Flüssigkeit begleitet wird. So sehen wir die innige Beziehung zwischen transversalen akustischen Phononen (oder Transversalwellen) und dem Beginn der Steifigkeit bei Vitrifikation. wie durch Bartenev in seiner mechanischen Beschreibung des Verglasungsprozesses beschrieben. [39] [40]
Die Geschwindigkeiten der longitudinalen akustischen Phononen in kondensierter Materie sind direkt verantwortlich für die Wärmeleitfähigkeit, dass das Niveau aus Temperaturdifferenzen zwischen komprimiert und Volumenelemente erweitert. Kittel vorgeschlagen, dass das Verhalten von Gläsern in Bezug auf eine annähernd konstanten interpretiert wird für Gitterphononen „mittleren freien Weglänge“, und dass der Wert des mittleren freien Weglänge von der Größenordnung der Skala der Unordnung in der molekularen Struktur von a flüssig oder fest. Die thermischen Phononen mittlere freie Weglängen oder Entspannungslängen einer Anzahl von Glasbildnern haben im Vergleich zu der Glasübergangstemperatur aufgetragen wurden. was auf eine lineare Beziehung zwischen den beiden. Dies hat ein neues Kriterium für die Glasbildung vorgeschlagen auf dem Wert der Phonon-basierte mittleren freien Weglänge. [41]
Es wird oft vorgeschlagen worden, dass der Wärmetransport in dielektrische Feststoffen durch elastische Vibrationen des Gitters auftritt, und daß dieser Transport wird durch die elastische Streuung von akustischen Phononen durch Gitterfehler (z.B. zufällig beabstandeten offene Stellen) begrenzt. [42] wurden diese Vorhersagen durch Experimente an kommerziellen Gläsern und Glaskeramiken bestätigt. in der mittleren freien Weglängen wurden offensichtlich durch „innere Grenze scattering“ auf Längenskalen von 10-100 Mikrometern (0,00039 bis 0,00394 in) begrenzt. [43] [44] Die Beziehung zwischen diesen Transversalwellen und dem Mechanismus der Vitrifikation von mehreren Autoren beschrieben worden ist, der, dass der Beginn von Korrelationen zwischen solchen Phononen zu einer Orientierungs Ordnungs- oder „Einfrieren“ der lokalen Scherspannungen in vorgeschlagenen glasbildendem Flüssigkeiten, wodurch man so den Glasübergang. [45]
Elektronische Struktur bearbeiten
Der Einfluss von thermischen Phononen und ihre Wechselwirkung mit elektronischer Struktur ist ein Thema, das in einer Diskussion des Widerstands von Flüssigmetallen entsprechend eingeführt wurde. Lindemann Theorie des Aufschmelzens wird Bezug genommen wird, und es wird vorgeschlagen, dass der Abfall der Leitfähigkeit beim Übergang von der kristallinen in den flüssigen Zustand ist aufgrund der erhöhten Streuung von Leitungselektronen als Ergebnis der erhöhten Amplitude atomarer Schwingung. Solche Theorien wurden Lokalisierungs in metallischen Gläsern zu transportieren aufgetragen. wo die mittleren freien Weglänge der Elektronen sind sehr klein (in der Größenordnung von dem interatomaren Abstand). [46] [47]
Die Bildung einer nicht-kristalline Form einer Gold-Silizium-Legierung durch das Verfahren der Splat Abschrecken aus der Schmelze führte zu weiteren Betrachtungen des Einflusses der elektronischen Struktur auf Glasbildungsfähigkeit, basierend auf den Eigenschaften der metallischen Bindung. [48] [49] [50] [51] [52]
Andere Arbeit zeigt, dass die Mobilität der lokalisierten Elektronen durch das Vorhandensein von dynamischen Phononenmoden verstärkt wird. Ein Anspruch gegen ein solches Modell ist, dass, wenn chemische Bindungen wichtig sind, die nahezu freie Elektronen Modelle nicht anwendbar sein sollte. Wenn jedoch das Modell zwischen allen Paaren von Atomen, wie eine chemische Bindung (z.B. Silizium, wenn eine Band nur mit Elektronen gefüllt ist), um den Aufbau einer Ladungsverteilung enthält, dann sollte es auf Feststoffe anwendbar. [53]
Es wurde auch behauptet worden, daß in metallischen Systemen Glasbildung auf die „Weichheit“ des Wechselwirkungspotential zwischen ungleichen Atomen in Beziehung steht. Einige Autoren, die starken Ähnlichkeiten zwischen der lokalen Struktur des Glases betont und dem entsprechenden Kristall, deuten darauf hin, dass die chemische Bindung hilft, die amorphe Struktur zu stabilisieren. [54] [55]
Andere Autoren haben vorgeschlagen, dass die elektronische Struktur, seinen Einfluss auf die Glasbildung durch die Richtungseigenschaften von Anleihen ergibt. Nicht-Kristallinität wird somit in Elementen mit einer großen Anzahl von polymorphen Formen und einem hohen Grad an Bindungs Anisotropie bevorzugt. Die Kristallisation wird unwahrscheinlicher als Haft Anisotropie von isotropen metallischen Metallteilchen mit anisotroper erhöht wird kovalente Bindung an, so dass eine Beziehung zwischen der Gruppennummer in dem Periodensystem darauf hindeutet, und die Glasbildungsfähigkeit in elementarem Feststoff. [56]