Hypertonische Dextrose-Injektion - FDA Verschreibungsinformationen, Nebenwirkungen und Anwendungen
Hypertonische Dextrose-Injektion - Klinische Pharmakologie
Hypertonische Dextrose Injections, bieten USP Kalorien und sind eine Quelle von Wasser für Trink. Diese Lösungen sind in der Lage zu induzieren Diurese abhängig vom klinischen Zustand des Patienten.
Hypertonische Dextrose-Lösungen bieten eine maximale Kalorienquelle in einem minimalen Flüssigkeitsvolumen.
Indikationen und Gebrauch für Hypertonische Dextrose-Injektion
Diese intravenösen Lösungen sind für den Einsatz bei Erwachsenen und Kindern als Quellen von Kalorien und Wasser für Trink angegeben.
Gegenanzeigen
Die Verabreichung von Lösungen hypertonen Dextrose enthalten, wird bei Patienten mit intrakraniellen oder intraspinale Blutungen, diabetisches Koma oder Delirium tremens kontra, vor allem, wenn solche Patienten, die bereits dehydriert sind.
Die Verabreichung von intravenösen Lösungen kann dazu führen, Fluid und / oder Überlast gelöste Stoff in Verdünnung von Serumelektrolytkonzentrationen führt, Überwässerung, lasten Zustände oder Lungenödem. Das Risiko von dilutional Staaten ist umgekehrt proportional zu der Elektrolytkonzentration.
Lösungen Dextrose ohne Elektrolyte enthalten, sollen nicht gleichzeitig mit Blut durch die gleiche Infusionsset wegen der Möglichkeit der Agglomeration verabreicht werden.
Vorsichtsmaßnahmen
Lösungen, die Dextrose sollten mit Vorsicht bei Patienten mit manifester oder bekannten subklinischer Diabetes mellitus oder Kohlenhydrat-Intoleranz aus irgendeinem Grunde verwendet werden.
Wesentliche Elektrolyte, Mineralien und Vitamine sollten je nach Bedarf geliefert werden.
Wenn Infusionen konzentrierter Dextrose eingestellt werden, ist es ratsam, eine Lösung von 5% oder 10% Dextrose zu ersetzen Rebound Hypoglykämie zu verhindern.
Diese Lösungen sind zur intravenösen Verabreichung bestimmt sterile Ausrüstung. Es wird empfohlen, dass die intravenöse Verabreichung Gerät mindestens einmal alle 24 Stunden ersetzt werden.
Verwenden Sie nicht, wenn Lösung klar ist, Verschluss intakt ist und Vakuum vorhanden ist.
Diese Arzneimittel enthalten nicht mehr als 25 μ g / l Aluminium.
Labortests
Wechselwirkungen mit anderen Medikamenten
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit
Studien mit Hypertonische Dextrose Injections, USP haben nicht zu bewerten kanzerogenen Potenzial, mutagene Potential oder Auswirkungen auf die Fertilität durchgeführt.
Schwangerschaft Kategorie C
Tierstudien haben nicht mit Hypertonische Dextrose Injections, USP durchgeführt. Es wird auch, ob Hypertonische Dextrose Injections nicht bekannt, USP fetale Schäden verursachen kann, wenn es um eine schwangere Frau oder die Fortpflanzungsfähigkeit beeinträchtigen können. Hypertonische Dextrose Injections, USP sollte nur, wenn dies unbedingt erforderlich ist, um eine schwangere Frau verabreicht werden.
Arbeit und Lieferung
Wie in der Literatur berichtet, haben Dextrose-Lösungen wurden während der Wehen und Geburt verabreicht. Vorsicht ist angezeigt, und die Flüssigkeitsbilanz, Glucose und Elektrolytkonzentrationen und Säure-Basen-Gleichgewicht, der Mutter und den Fötus sollte periodisch oder immer dann, wenn von dem Zustand des Patienten oder dem Fötus gerechtfertigt ausgewertet werden.
Stillende Mutter
Da viele Arzneimittel in die Muttermilch ausgeschieden werden, ist Vorsicht geboten, wenn Hypertonische Dextrose Injections, USP bei stillenden Frauen sind.
pädiatrische Verwendung
Serumglukosekonzentrationen werden sollten häufig kontrolliert, wenn Dextrose zu pädiatrischen Patienten verschrieben wird, insbesondere Geborenen, Neugeborenen und niedriges Geburtsgewicht.
Geriatric Verwenden
Nebenwirkungen
Wenn eine negative Reaktion auftritt, unterbrechen die Infusion, bewerten die Patienten, Institut geeignete therapeutische Gegenmaßnahmen und den Rest der Flüssigkeit zur Prüfung speichern, wenn für notwendig erachtet.
Überdosierung
Im Falle einer Flüssigkeit oder gelöster Stoff Überlastung während parenterale Therapie, neu zu bewerten und sich der Zustand des Patienten Institut geeignete korrigierende Behandlung.
Hypertonische Dextrose-Injektion Dosierung und Verabreichung
Diese Lösungen sind nur für die intravenöse Anwendung. Hypertonische verabreichen nur nach Verdünnung über zentrale Venenkatheter.
Die Dosierung ist von einem Arzt geleitet werden und ist abhängig von Alter, Gewicht, klinischen Zustand der Patienten und Laborbestimmungen. Häufige Laboratoriumsuntersuchungen und klinische Bewertung sind wesentliche Änderungen zur Überwachung der Blutglukose und Elektrolytkonzentrationen und Flüssigkeits- und Elektrolythaushaltes bei parenteraler Therapie.
Zu sollte für jeden Patient basierend auf berechnete Wartung oder Ersatzflüssigkeit Anforderungen werden.
Parenterale Arzneimittel sollten visuell auf Partikel und Verfärbungen vor der Verabreichung, wann immer Lösung und Behältnisse zulassen inspizieren.
pädiatrische Verwendung
Es gibt keine spezielle pädiatrische Dosis. Die Dosis ist abhängig von Gewicht, klinischem Zustand und Laborergebnissen. Befolgen Sie die Empfehlungen der entsprechenden pädiatrischen Referenztext. (Siehe Warnhinweise und Vorsichtsmaßnahmen.)
Wie wird Hypertonische Dextrose-Injektion Lieferung
Hypertonen Dextrose Injections, USP sind steril und nicht pyrogen in Vollfüllung und Teilfüllung Glasbehältern mit festen Anschlägen geliefert. Die 1000-ml-Behälter werden 6 pro Hülle verpackt und die 500-ml-Behälter werden 12 pro Tasche verpackt.
Die Exposition von pharmazeutischen Produkten sollte werden, um Wärme minimiert. Vermeiden Sie übermäßige Hitze. Vor Frost schützen. Es wird empfohlen, dass das Produkt bei Raumtemperatur (25 ° C / 77 ° F) gelagert werden; jedoch kurze Exposition bis zu 40 ° C / 104 ° F nicht negativ auf das Produkt auswirken.
Hinweise zur Verwendung von B. Braun Glasbehälter mit Solid Stoppers
Vor der Verwendung Führen Sie die folgenden Prüfungen durch:
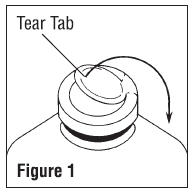
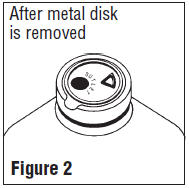
Achtung: Große, teilweise gefüllte Behälter (ein Liter und größer) haben Hochvakuum große Additionen oder Übertragungen zu erleichtern. Dies schafft eine Implosion Gefahr und erfordert besondere Sorgfalt bei der Verwendung und Handhabung.
Hinweis: Abweichungen in Farbe zwischen verschiedenen Chargen und zwischen den Einheiten von der gleichen Charge, ist normal für Kohlenhydratlösungen und Elektrolytlösungen enthalten Zucker. Diese Farbunterschiede haben keine Auswirkung auf den therapeutischen Wert der Lösungen.
B. Braun Medical Inc.
Irvine, CA 92614-5895 USA
Hergestellt in den USA
In Kanada, vertrieben durch:
B. Braun Medical Inc.
Scarborough, Ontario M1H 2W4
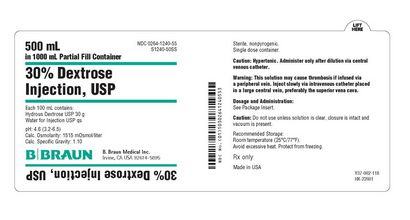
PRINCIPAL DISPLAY PANEL - 500 ml Behälteretikett
500 ml
in 1000 ml Partial Fill Container
NDC 0264-1240-55
S1240-50SS
30% Dextrose
Injektion, USP
Jede 100 ml enthält:
Wasserhaltige Dextrose USP 30 g
Wasser für die Injektion USP qs
pH 4,6 (3,2-6,5)
Calc. Osmolarität: 1515 mOsmol / Liter
Calc. Spezifisches Gewicht: 1.10
B. Braun Medical Inc.
Irvine, CA USA 92614-5895
Steril, pyrogenfrei.
Einzeldosisbehälter.
Achtung: Hypertonische. Administrieren nur nach Verdünnung über zentrale
Venenkatheter.
Dosierung und Anwendung:
Siehe Beipackzettel.
Achtung: Verwenden Sie nur verwenden, wenn Lösung klar ist, Verschluss intakt ist und
Vakuum vorhanden ist.
Empfohlene Lagerung:
Raumtemperatur (25 ° C / 77 ° F).
Vermeiden Sie übermäßige Hitze. Vor Frost schützen.
PRINCIPAL DISPLAY PANEL - 500 ml Behälteretikett
500 ml
in 1000 ml Partial Fill Container
NDC 0264-1280-50
S1280-50SS
50%
TRAUBENZUCKER
Injektion, USP
Jede 100 ml enthält:
Wasserhaltige Dextrose USP 50 g
Wasser für die Injektion USP qs
pH-Wert: 4,6 (3,2-6,5)
Calc. Osmolarität: 2525 mOsmol / Liter
Calc. Spezifisches Gewicht: 1,17
B. Braun Medical Inc.
Irvine, CA 92614-5895 USA
Steril, pyrogenfrei. Einzeldosisbehälter.
Achtung: Hypertonische. Administrieren nur nach Verdünnung über
zentrale Venenkatheter.
Dosierung und Anwendung:
Siehe Beipackzettel.
Achtung: Verwenden Sie nur verwenden, wenn Lösung klar ist, Verschluss intakt
und Vakuum vorhanden ist.
Empfohlene Lagerung:
Raumtemperatur (25 ° C / 77 ° F). Vermeiden Sie übermäßige Hitze.
Vor Frost schützen.
Hergestellt in den USA
HK-22602
Y37-002-261 LD-290-1

PRINCIPAL DISPLAY PANEL - 1000 mL Container Etikett
Kanada DIN 01924273
NDC 0264-1280-55
S1280-SS
50%
TRAUBENZUCKER
Injektion, USP
NICHT FÜR DIREKTE INFUSION MÜSSEN VERDÜNNTE
Jede 100 ml enthält:
Wasserhaltige Dextrose USP 50 g
Wasser für die Injektion USP qs
pH-Wert: 4,6 (3,2-6,5), hypertone
Calc. Osmolarität: 2525 mOsmol / Liter
Calc. Spezifisches Gewicht: 1,17
B. Braun Medical Inc.
Irvine, CA USA 92614-5895
Steril, pyrogenfrei.
Einzeldosisbehälter.
Dosierung und Anwendung:
Siehe Beipackzettel.
Achtung: Verwenden Sie nur verwenden, wenn Lösung klar ist, Verschluss intakt
und Vakuum vorhanden ist.
Empfohlene Lagerung:
Raumtemperatur (25 ° C / 77 ° F).
Vermeiden Sie übermäßige Hitze. Vor Frost schützen.
In Kanada, vertrieben durch:
B. Braun Medical Inc.
Scarborough, Ontario M1H 2W4
Hergestellt in den USA
Y37-002-124
HK-22602

PRINCIPAL DISPLAY PANEL - 500 ml Behälteretikett
500 ml
in 1000 ml Partial Fill Container
Kanada DIN 01924265
NDC 0264-1290-50
S1290-50SS
TRAUBENZUCKER
Injektion, USP
70%
Jede 100 ml enthält:
Wasserhaltige Dextrose USP 70 g
Wasser für die Injektion USP qs
pH 4,6 (3,2-6,5)
Calc. Osmolarität: 3530 mOsmol / Liter
Calc. Spezifisches Gewicht: 1,23
B. Braun Medical Inc.
Irvine, CA USA 92614-5895
Steril, pyrogenfrei. Einzeldosisbehälter.
Achtung: Hypertonische. Administrieren nur nach Verdünnung über zentrale
Venenkatheter.
Dosierung und Anwendung:
Siehe Beipackzettel.
Achtung: Verwenden Sie nur verwenden, wenn Lösung klar ist, Verschluss intakt ist und
Vakuum vorhanden ist.
Empfohlene Lagerung:
Raumtemperatur (25 ° C / 77 ° F).
Vermeiden Sie übermäßige Hitze. Vor Frost schützen.
In Kanada, vertrieben durch:
B. Braun Medical Inc.
Scarborough, Ontario M1H 2W4
Y37-002-127 (HK-22603)
Hergestellt in den USA
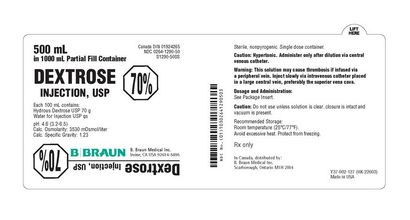
PRINCIPAL DISPLAY PANEL - 1000 mL Container Etikett
NDC 0264-1290-55
S1290-SS
Dextrose-Injektion, USP
70%
NICHT FÜR DIREKTE INFUSION
MÜSSEN VERDÜNNTE
Jede 100 ml enthält:
Wasserhaltige Dextrose USP 70 g
Wasser für die Injektion USP qs
pH-Wert: 4,6 (3,2-6,5), hypertone
Calc. Osmolarität: 3530 mOsmol / Liter
Calc. Spezifisches Gewicht: 1,23
B. Braun Medical Inc.
Irvine, CA USA 92614-5895
Steril, pyrogenfrei.
Einzeldosisbehälter.
Dosierung und Anwendung:
Siehe Beipackzettel.
Achtung: Verwenden Sie nur verwenden, wenn Lösung klar ist, Verschluss intakt
und Vakuum vorhanden ist.
Empfohlene Lagerung:
Raumtemperatur (25 ° C / 77 ° F). Vermeiden Sie übermäßige Hitze.
Vor Frost schützen.
Hergestellt in den USA
Y37-002-128
HK-22603
