Konzentration einer Lösung, Suche nach der Konzentration einer Lösung, Chemie @
Arten der Lösung
Das Finden der Konzentration einer Lösung
Die Konzentration einer Lösung ist die Menge des gelösten Stoffes in einer bekannten Menge des Lösungsmittels oder die Lösung gelöst. Lösung kann als verdünnte oder konzentrierte Lösung nach ihrer Konzentration beschrieben. Eine verdünnte Lösung hat eine sehr kleine Menge des gelösten Stoffes während Konzentratlösung eine große Menge des gelösten Stoffes in der Lösung hat. Verschiedene Konzentration Begriffe sind wie folgt.
1. Massenprozent
Masse% = $ \ frac $ x 100 beispielsweise die prozentuale Zusammensetzung von Masse einer 100 g Zuckerlösung, die 15 g Zucker enthält, wird
2. Volumenprozent
Es kann als% v / v oder Volumen% dargestellt werden, und verwendet, um solche Lösungen herzustellen, bei denen beide Komponenten in Flüssigkeiten Zustand sind. Es ist die Anzahl der Teile des Volumen des gelösten Stoffes pro hundert Volumenteile Lösung. Deswegen,
Volumen% = $ \ frac $ x 100% beispielsweise 20% ige Lösung von Ethanol Volumen bedeutet, dass 100 cm 3 der Lösung enthält 20 cm 3 Ethanol und 80 cm 3 Wasser.
3. Massen-Volumenanteil (W / V%)
4. Teile pro Million (ppm)
Die sehr niedrige Konzentration des gelösten Stoffes in der Lösung kann in ppm ausgedrückt werden. Es ist die Anzahl der Masseteile des gelösten Stoffes pro Million Gewichtsteile der Lösung.
5. Molanteil (X)
Molenbruch wird, hängt nicht von der Temperatur ab und kann auf Lösungen erweitert werden, um mehr als zwei Komponenten aufweisen.
6. Molarität (M)
Molarität gebräuchlichste Einheit zur Konzentration der Lösung. Es wird in einem ml Lösung in einem Liter oder eine dm3 der Lösung des gelösten Stoffes oder Millimol vorhanden vorhanden wie die Anzahl der Gramm-Mol des gelösten Stoffes definiert.
Mathematisch kann es wie folgt ausgedrückt werden
- Da Mol des gelösten Stoffes = Masse des gelösten Stoffes in Gramm / Molare Masse des gelösten Stoffes
- Daher ist M = Masse des gelösten Stoffes in Gramm / Molare Masse des gelösten Stoffes x Volumen der Lösung (L)
- Wenn nB Mol des gelösten Stoffes B vorhanden sind, in V Liter Lösung.
Wo MB ist die molare Masse des gelösten Stoffes und WB ist die Gramm des gelösten Stoffes in V (ml) Lösung. Ein molarer Lösung wird als Lösung mit Molarität Einheit definiert. Solche Lösungen haben pro Liter Lösung ein Mol des gelösten Stoffes. Die Einheit der Molarität mol / l oder mol dm 3-.
7. Molalität (m)
Die Anzahl der Gramm-Mol des gelösten Stoffes, die in 1000 g des Lösungsmittels wird als Molalität der Lösung bekannt. Es repräsentiert durch Buchstaben ‚m‘.
Die Einheit der Molalität mol / kg und es durch die Temperatur beeinflusst nicht.
8. Normality (N)
Die Anzahl der Grammäquivalent des gelösten Stoffes in einem Liter Lösung wird als Normalität der Lösung bekannt. Mit anderen Worten; Anzahl der Milliäquivalente des gelösten Stoffes in ein ml Lösung wird als Normalität dieser Lösung genannt. Es repräsentiert durch Buchstaben ‚N‘.
Um eine Lösung mit Normalität gleich Eins ist als normale Lösung bekannt. Eine solche Lösung enthält ein Grammäquivalent des gelösten Stoffes pro dm 3 der Lösung aus.
Die Berechnung der Konzentration einer Lösung
Die Konzentration der Lösung kann im Hinblick auf die Normalität, Molarität, Molalität oder Molenbruch berechnet werden.
gelöst Beispiele
Frage 1: Berechne die Molenbrüche der Komponenten der Lösung von 92 g Glycerin und 90 g Wasser zusammengesetzt?
(M (Wasser) = 18; M (Glycerin) = 92)
Lösung:
Mol Wasser = 90 g x 1 mol / 18 g = 5 Mol Wasser
Mol Glycerin = 92 g x 1 mol / 92 g = 1 Mol Glycerin
Gesamtzahl der Mole in Lösung = 5 + 1 = 6 mol
Molenbruch von Wasser xwater = 5 mol / mol = 0,833 6
Molenbruch von Glycerin xglycerol = 1 mol / mol = 0,167 6
Frage 2: Wie wird die Molarität der Lösung sein, wenn Wasser auf 10 g CaCO3 zugesetzt wird, 100 ml Lösung zu machen?
Lösung:
10 g CaCO 3 / (100 g CaCO3 / mol CaCO3) = 0,10 mol CaCO3
100 ml x 1 L / 1000 ml = 0,10 L
Molarität = Mole des gelösten Stoffes / Volumen der Lösung (L) = 0,10 mol / 0,10 L
Deswegen; Molarität von gegebener Lösung = 1,0 M
Frage 3: Berechne die Molalität einer Lösung, die 20 g Natriumhydroxid (NaOH) in 250 g Wasser, enthaltend?
Lösung:
Mol Natriumhydroxid = 20 g NaOH / (40 g NaOH / 1 mol NaOH) = 0,2 mol NaOH
250 g = 0,25 kg Wasser (250 g Wasser x 1 kg / 1000 g = 0,25 kg)
Daher Molalität der Lösung = Mole des gelösten Stoffes / Masse des Lösungsmittels (kg) = 0,2 mol / kg 0,25
oder Molalität (m) = 0,8 M / kg oder 0,8 m
Frage 4: Berechne die Anzahl von Gramm Kupfersulfat (CuSO4) benötigten 250,0 ml 1,00 M CuSO4 vorzubereiten?
Lösung:
Molare Masse von Kupfersulfat = 159,6 g / mol
V = 250 ml
Molarity = 2,00m
Konzentration von Ionen in einer Lösung
Im Allgemeinen sind wir mit ionischen Verbindungen in verschiedenen Reaktionen. Ionische Verbindungen sind gute Leiter in ihrer wässrigen Lösung aufgrund der Anwesenheit von Ionen in Lösung. Daher in ionischen Verbindungen die Bestimmung der Konzentration von Ionen ist nützlicher als Konzentration der Lösung. Zur Bestimmung der Konzentration von Ionen in der Lösung, zuerst müssen wir Balance chemische Gleichung schreiben, die zeigen, wie diese Substanzen in Ionen brechen.
Beispielsweise kann die Dissoziation von Kaliumcarbonat in wässrigem wie folgt geschrieben werden.
Jedes Mol K2 CO3 erzeugt zwei Mol K + -Ionen und zwei Mol Carbonationen in Lösung ohne Volumenveränderung. Nun, wenn wir 0,40 M Lösung von Kaliumcarbonat (K2 CO3), die Konzentration beiden Ionen. K + und CO3 2- kann durch die Verwendung der Koeffizienten in unserer ausgewogenen Gleichung berechnet werden.
Die Konzentration von Kaliumionen, [K +] = 2 × [K2 CO3] = 2 × 0,40 = 0,80 M M
Konzentration von Carbo [CO3 2-] = 1 × [K2 CO3] = 1 x 0,40 = 0,40 M M
Lassen Sie sich die Konzentration der Ionen in 0,30 M Lösung von Eisen (III) -nitrat berechnen. Die ausgeglichene chemische Gleichung der Dissoziation von Eisen (III) nitrat in seiner wässrigen Lösung ist wie folgt;
Konzentration an [Fe 3+] = 1 x [Fe (NO3) 3] = 1 x 0,30 = 0,30 M
Die Konzentration von [NO3 -] = 3 × [Fe (NO3) 3] = 3 × 0,30 = 0,90 M
Beispiel 1
Berechnen Ionenkonzentrationen in einer 3,00 l-Lösung, enthaltend 17,1 g Aluminiumsulfat, Al 2 (SO 4) 3. (Atommasse von Al = 27,0 g / mol, O = 16 g / mol, S = 32,0 g / mol)
Molare Masse von Aluminiumsulfat = 2 × 27,0 × 3 + 12 × 32.0.0 + 16,0 = 342,0 g / mol
Konzentration von Al2 (SO4) 3 = Masse des Al2 (SO4) 3 / Molare Masse von Al2 (SO4) 3 x V (L)
= 17,1 /342.0 x 3 = 0,0166 M
Dissoziation von Aluminiumsulfat in seiner wässrigen Lösung kann geschrieben werden als
Aus ausgeglichener Gleichung für die Dissoziation;
Die Konzentration von [Al 3+] = 2 × [Al2 (SO4) 3] = 2 × 0,0166 = 0,0333 M bzw. 3,33 × 10 -2 M
Die Konzentration von [SO4 2-] = 3 × [Al2 (SO4) 3] = 3 x 0,0166 = 0,0498 M bzw. 4,98 × 10 -2 M
Was ist die Konzentration der Natrium- und Sulfationen in einer 0,650 M Lösung von Na 2 SO 4?
Die Dissoziation von Natriumsulfat in der wässrigen Lösung kann geschrieben werden;
Die Konzentration von Natrium- und Sulfationen werden
Konzentration von Natriumionen; [Na +] = 0,650 M Na 2 SO 4 x 2 Na + / 1 Na2 SO4 = 1,3 M Na +
Konzentration von Sulfationen; [SO4 2-] = 0,650 M Na2 SO4 x1SO4 2- / 1 Na2 SO4 = 0,650 M SO4 2-
Wie Molarität der Konzentration der Lösung ausgedrückt verwendet wird, wird verwendet, um die Formalität Konzentration der Ionen in Lösung zu berechnen. Es ist die Anzahl der Formel Gewichtseinheiten des gelösten Stoffes in einem Liter Lösung. Formalität wird durch Buchstaben ‚F‘ dargestellt. Die Masse von einem Mol einer Verbindung entspricht die Formel Gewicht in Gramm. Formalität wird zur Bestimmung der Anzahl der Mole einer Verbindung, die aus der Anzahl der Mole von Ionen in Lösungen von ionischen Verbindungen eingesetzt.
Die Bestimmung der Konzentration eines Laws Lösung Bier
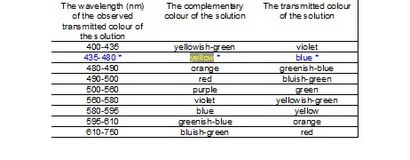
Die Eigenschaften von Licht können durch Wellenlänge und Frequenz beschrieben. Auf der Grundlage der Wellenlänge und Frequenz, kann Licht in verschiedenen Typen eingeteilt werden. Aus diesen Strahlungen, nur sichtbares Licht kann durch das menschliche Auge zu sehen. Die Wellenlänge des sichtbaren Lichts liegt zwischen 400 nm bis 750 nm.
Woher ,
A = Extinktion von Licht bei gegebenen Wellenlängen -1 cm -1)
b = Weglänge durch die Lösung, die das Licht zurücklegen muss (cm)
c = Konzentration der Lösung (mol / l)
Da die Absorption einer bestimmten Farbe des Lichts zunimmt, nimmt die Farbe der Lösung steigt in diesem Bereich des Spektrums, der nicht durch Lösung absorbiert wird. Die Absorption (A) ist die Konzentration der Lösung direkt proportional steigt daher mit der Konzentration der Lösung zu erhöhen.
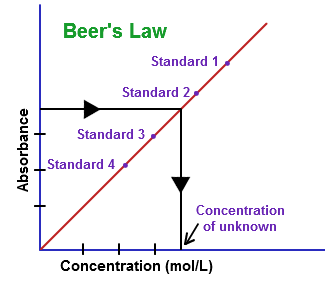
Für die Bestimmung der Konzentration der Lösung einer unbekannten Probe, die Absorption von einer Reihe von bekannter Lösung wird gemessen und aufgezeichnet, die als Beer'schen Gesetz Handlung oder Eichkurve genannt wird. Diese Kurve kann durch Messung der Absorption bei gleicher Wellenlänge und Weglänge für die Bestimmung der Konzentration der unbekannten Probe verwendet werden.
Kolorimetrie wird zur Bestimmung der Konzentration der Lösung, die auf die Beziehung zwischen Absorption und Pfadlänge basiert verwendet. Da molares Absorptionsvermögen für jede absorbierende Spezies einzigartig ist und mit der Wellenlänge variieren, daher jede Summe Weglänge und Konzentration wird gleich sein, wenn multipliziert wird die gleiche Menge an Licht absorbieren. Die Absorption wird im Zusammenhang mit Aussehen der Lösung, also zwei Lösungen (A1 und A2) mit dem gleichen Farbe werden gleiche Absorption zeigen.
e 1 = e 2 (für gleiche Substanz)
Deswegen
B1C1 = B2C2
Oder
B1C1 = B2C2. (2)
Die Konzentration der unbekannten Lösung kann durch die Verwendung der Gleichung (2) bestimmt werden.
- A1 = Absorption der bekannten Lösung
- e 1 = molares Absorptionsvermögen der bekannten Lösung
- c1 = Konzentration der bekannten Lösung
- A2 = Absorption unbekannter Lösung
- e 2 = molares Absorptionsvermögen von unbekannter Lösung
- C2 = Konzentration unbekannter Lösung
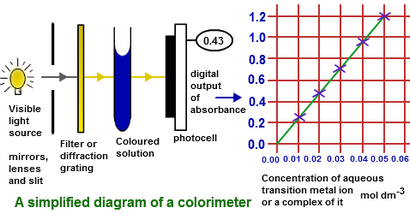
Zum Beispiel Konzentration der unbekannten Lösung von Nickelsulfat kann unter Verwendung einer bekannten Lösung von derselben Verbindung in Colorimeter bestimmt werden. Diese Lösung wird als Standardlösung bekannt und müssen tiefgrüne Farbe haben. Ein Kolorimeter besteht aus einem roten Licht von LED-Quelle, die durch Lösung gelangt und Photozellen auftreffen.
Da verleumdete Lösung von Nickelsulfat ist tief in der Farbe, daher konzentrierter und mehr Licht als eine Lösung mit niedriger Konzentration absorbierte. Das übertragene Licht wird durch Lichtschranke überwacht. Messung der Absorption einer Reihe von bekannten Lösung unter Verwendung von Standard-Lösung und Plots eine graphische Darstellung zwischen der Absorption und der Konzentration der Lösungen hergestellt. Die Grafik zeigt einen Gerade mit positiven Slop wie nach Beer-Lambert-Gesetz.
misst in ähnlicher Weise die Absorption von unbekannter Nickelsulfatlösung mit dem Colorimeter. Nun können wir die Absorption dieser Lösung auf der vertikalen Achse des Graphen und die entsprechenden Konzentration finden kann auf der horizontalen Achse zu finden.