Puffer (Molecular Biology)
1. Grundlagen
Der Begriff Pufferlösung Regel bezieht sich auf eine Lösung, die Änderungen des pH minimiert, wenn Wasserstoffionen (hydrons, H +) werden zu der Lösung gegeben oder daraus entfernt. (Wie in Regelwerk1 diskutiert, hat IUPAC Hydron genehmigte ein Wasserstoffkation zu bezeichnen, wenn ein Begriff, unabhängig von Wasserstoffisotop gewünscht wird.) Eine solche Lösung soll daher den pH-Wert puffern. Lösungen können auch andere Spezies puffern ausgelegt sein, insbesondere Metallionen, wie weiter unten beschrieben.
Da die Konzentration von Wasserstoffionen in biologischen Medien ist gering, in der Regel etwa 0,1 | iM, könnte es stark durch die Produktion oder den Verbrauch von sehr geringen Mengen an Wasserstoffionen in der chemischen Reaktionen verändert werden. Dies ist, was in Experimenten in der Molekularbiologie Pufferung häufig erforderlich macht. Das Prinzip eines Puffers ist einfach. Bezogen auf die geringe Konzentration an freien Wasserstoffionen besteht der Puffer von vielen höheren Konzentrationen von sowohl einer Base A "(dh eine Substanz, die reversibel mit den hydrons kombinieren kann) und ihre konjugierte Säure HA, die gebildet wird, wenn die Basis kombiniert mit einem Hydron. Daraus ergibt sich die Gleichgewichts
ist festgelegt. Anschließend führt jede Zugabe von H + eine viel geringere Zunahme in seiner freien Konzentration, [H +], weil einige der hydrons verbraucht sind mehr HA bei der Herstellung dieses Gleichgewicht nach links zu verschieben. In ähnlicher Weise wird jeder Fall in [H +] vermindert, weil es auf die Dissoziation von HA führt.
2. Einfache Theorie
Benutzer von Puffern müssen sich bewusst viele Merkmale ihrer Aktion sein, wenn sie nicht sind, Fehler machen, die ihre Experimente leicht ruinieren. Dazu wird ein wenig Theorie der Pufferlösungen erforderlich.
2.1. Dissoziation von Wasser
Wasser dissoziiert spontan in ein Wasserstoffion und ein Hydroxidion:
der pH 7. Die pH-Skala in Wasser über etwa den Bereich von 0 bis 14, über die [H +] variiert nützlich ist
2.2. Der pKa und der pH-Wert
Die Säure HA wird eine Dissoziationskonstante hat, Ka, die Gleichgewichtskonstante für die Reaktion (1), die definiert ist als
Umstellen diese finden [H +] gibt
und den negativen Logarithmus von jeder Seite unter die pH-Wert [GI zu finden. (3)] gibt
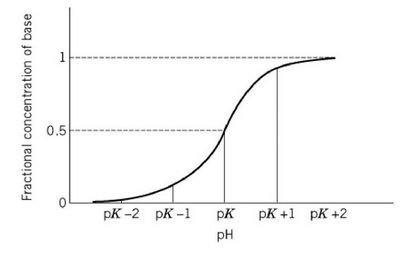
2.3. Theorie des Buffering
Bei richtig gepufferten Lösungen, die beide [A-] und [HA] werden viel größer als [H +] und [OH & supmin;]. In diesem Fall kann jedes H + in einer Reaktion erzeugt wandelt A- in HA und jedes H + aufgenommen dissoziiert von HA er in A- zu konvertieren. Um die Folgen davon, ist es bequem, die Henderson-Hasselbach-Gleichung wie folgt zu ändern:
3. Praktische Hinweise
3.1. pH-Messung
Methoden der pH-Messung sind nicht in den Anwendungsbereich dieses Artikels, aber der Prozess ist wichtig, weil die Reproduzierbarkeit der Pufferherstellung hängt oft von ihm (siehe unten). Die gebräuchlichste Methode verwendet eine Glaselektrode. Dieses Verfahren hängt die Elektrode in die Lösung auf dem Eintauchen in der Weise geprüft werden, dass eine elektrische Zelle erzeugt wird und daß das Potential durch diese Zelle gegeben ist abhängig vom pH-Wert der Lösung. Normalerweise trennt eine Schicht aus dünnem Glas, die Lösung unter Test von einem einen der Elektroden der Zelle enthält. Dieses Glas ist selektiv permeabel hydrons, so daß das Potential über es auf dem pH-Wert der Lösung abhängt. Vorausgesetzt, dass das andere Übergangspotential zwischen dieser Lösung und der anderen Elektrode vernachlässigbar-Bedingung durch eine Brücke enthält konzentriertes KCl-das Potential zuverlässig anzuzeigen, sollte den pH-Wert annähert.
3.2. Festlegen einer Pufferlösung
Pufferlösungen werden häufig in einer herkömmlichen Art und Weise angegeben wird, wie beispielsweise 0,2-M Natriumacetatpuffer, pH 4,8. Die angegebene Konzentration sollte auf die Summe der beiden Formen der Pufferung Arten beziehen, hier als [AcO-] und [HOAc] im Fall von Acetatpuffer, aber eine solche Spezifikation machen nicht ganz klar, wie diese Lösung erhalten worden ist . Es wurden durch (1) Mischen der geeigneten Mengen von Natriumacetat und Essigsäure hergestellt könnte worden, wie aus dem pK berechnet und der Henderson-Hasselbalch-Gleichung, (2) Zugeben von 0,2-M Natriumacetat auf 0,2 M Essigsäure, bis ein pH-Wert von 4,9 erreicht war, oder (3) Zugabe von starken NaOH auf 0,2 M Essigsäure-pH-Wert 4,9, unter der Annahme zu erreichen, daß das Volumen der Essigsäure vernachlässigbar verdünnt zugegeben. Es wäre nicht angemessen gewesen, jedoch zu stark HCl auf 0,2-M Natriumacetat wurden hinzugefügt, da dies NaCl hergestellt hätte zusätzlich zu den Pufferarten.
Messung der pH ist nicht einfach, insbesondere im Hinblick auf die Auswirkungen der Temperatur auf die Messungen (siehe oben); für die Reproduzierbarkeit, insbesondere zwischen verschiedenen Laboratorien, es viel sicherer ist es, die Konzentration jeder Form der Puffersubstanz, um anzugeben, dass das Materials mit einer Genauigkeit von 1% bis 2% mit einem Gewicht ausgegeben ist einfach. Selbst ein Fehler von 2% in jeder würde den pH-Wert durch nur log ändern (1,04), das heißt, von 0,017 einer pH-Einheit. Daher wäre es besser, den Puffer wie 0,12-M Natriumacetat, Essigsäure 0,08-M (pH 4,8) erwähnt zu beschreiben, wodurch der pH-Wert für die Zugabe Informationen und nicht als Teil der Definition.
3.3. Auswirkungen von Temperatur
Die Bedeutung dieser muss in jedem Experiment in Betracht gezogen werden. Wenn ein Benutzer die Glutamatreste eines Enzyms gewünscht in einem Experiment, bei 0 ° C in dem gleichen Ausmaß zu hydronated, wie sie in einem Puffer von pH 7 bei 20 ° C betragen würde, wäre es falsch, eine Amino-Puffer mit einem zu verwenden, pH-Wert von 7 bei 20 ° C und kühlt ihn einfach. Kühlung würde der pH-Wert des Puffers erhöhen, aber nicht der pKa der Rückstände, so dass diese Rückstände würden mehr distanzieren sich beim Abkühlen. Aber das wäre ein ordentliches Verfahren, wenn der Experimentator mit dem Zustand der Lysinreste besorgt ist, weil sie pKa mit, dass der Puffer Amin steigen würde, so dass der Grad ihrer hydronation würde die gleiche bleiben.
3.4. Auswirkungen der Konzentration
Viele chemische Reaktionen werden durch Säuren oder Basen katalysiert, so dass eine erhöhte Pufferkonzentration sie auch bei einem festen pH beschleunigen kann. Dies sollte berücksichtigt werden, wenn Pufferkonzentrationen zu verändern. Es ist nicht sehr üblich, enzymkatalysierten Reaktionen, da häufig die natürliche Selektion stellt sicher, dass, wenn eine solche Katalyse der Reaktion beschleunigt, wird eine entsprechende saure oder basische Gruppe in dem Enzym vorhanden sein, um es zu schaffen.
3.5. flüchtige Puffer
wird nach rechts verschoben, die un-ionisierten Formen zu ersetzen, wie sie entfernt werden.
Biologisches Material hat in der Regel einen pH-Wert in der Nähe von 7, und es ist nicht immer leicht, eine Puffer Spezies mit dem gewünschten pKa zu finden. Carbonsäuren besitzen Werte, die zu niedrig sind, während die Amine Werte haben, die zu hoch sind. Eine große Anzahl der üblicherweise verwendeten Puffer sind Amine mit elektronenziehenden Substituenten tragen, das freie Elektronenpaar an dem Stickstoffatom bilden weniger zur Verfügung und so der Atoms pKa senken. Beispiele beinhalten:
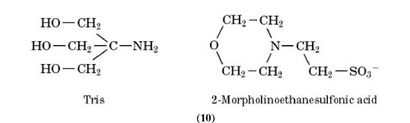
3.7. Die Notwendigkeit für Puffer-
Es sei daran erinnert, dass es sinnlos ist, einen Puffer zu addieren, wenn die Komponenten des Reaktionsgemisches sind bereits stark gepuffert werden. Glykolytischen Zwischenprodukte sind beispielsweise Phosphatester und sie zu einem pH-Wert in der Nähe von 7 eingestellt erzeugen eine gepufferte Lösung.
3.8. chemische Reaktivität
erzeugen kann, etwa 20 mM-Cyanat (CNO-) von 8 M Harnstoff (3). Der Schaden in diesem ist die umgekehrte Reaktion, weil die Cyanat Lysinresten in Proteinen carbamoylate kann, ungeladene Harnstoffe bilden und Destabilisierung des gefalteten Proteins. Dieser Vorgang wird minimiert, wenn Ammoniumionen, die in dem Puffer ist, wie sie mit dem Protein für die Cyanat- konkurrieren.