Halbwertzeiten und Zerfall Kinetics
Dieses Buch ist by-nc-sa 3.0 Lizenz unter einer Creative Commons-Lizenz. Sehen Sie sich die Lizenz für weitere Details, aber das ist im Grunde bedeutet, dass Sie dieses Buch gemeinsam nutzen können, solange der Urheber genannt (aber siehe unten), nicht damit Geld verdienen, und machen es für jedermann zugänglich sonst unter den gleichen Bedingungen.
PDF Kopien dieses Buches wurden mit Prinz erzeugt. ein großes Werkzeug für PDF-Dateien aus HTML und CSS zu machen. Mehr Details über den Prozess sind in dieser Blog-Post zur Verfügung.
Hat dieses Buch Ihnen geholfen? Betrachten Sie es vorbei an:
Creative Commons unterstützt freie Kultur von Musik auf Bildung. Ihre Lizenzen half dieses Buch Ihnen zur Verfügung zu stellen.
DonorsChoose.org hilft Menschen wie Sie Lehrer Projekte finanzieren ihren Unterricht helfen, von Malutensilien, um Bücher zu Rechner.
Vorhergehender Abschnitt
Inhaltsverzeichnis
Nächster Abschnitt
Lernziel
- Um zu wissen, wie Halbwertszeit zu verwenden, um die Raten der Reaktionen erster Ordnung zu beschreiben.
Halbwertzeit
Die Halbwertszeit einer Reaktion erster Ordnung unter einem gegebenen Satz von Reaktionsbedingungen ist eine Konstante. Dies gilt nicht für nullter und zweiter Ordnung Reaktionen. Die Halbwertszeit einer Reaktion erster Ordnung ist, unabhängig von der Konzentration der Reaktanten ab. Dies wird deutlich, wenn man das integrierte Geschwindigkeitsgesetz für eine Reaktion erster Ordnung (Gleichung 14,21) zu erzeugen, um die folgende Gleichung neu anzuordnen:
Setzt man [A] 0/2 für [A] und t1 / 2 für t in Gleichung (eine Halbwertszeit, um anzuzeigen) 14.27 gibt
Somit kann für eine Reaktion erster Ordnung, die jeweils aufeinanderfolgende Halbwertszeit ist die gleiche Zeit, wie in Abbildung 14.17 „die Halbwertszeit einer Reaktion erster Ordnung“ dargestellt. und ist unabhängig von [A].
Abbildung 14.17 Die Halbwertszeit einer Reaktion erste Ordnung
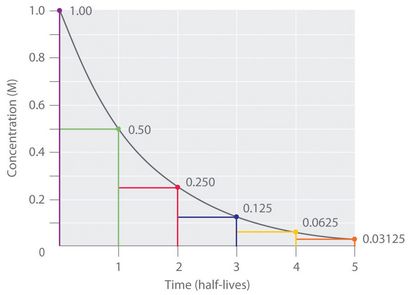
Wenn wir die Geschwindigkeitskonstante für eine Reaktion erster Ordnung kennen, dann können wir Halbwertzeiten verwenden, um vorherzusagen, wie viel Zeit benötigt wird, um die Reaktion einen bestimmten Prozentsatz Abschluss zu erreichen.
Anzahl der Halbwertzeiten
Wie man aus dieser Tabelle sieht, ist die Menge an Reaktant links nach n Halbwertszeit von einer Reaktion erster Ordnung (1/2) n-fache der Anfangskonzentration.
Beachten Sie die Muster
Beispiel 10
Gegeben: Geschwindigkeitskonstante, Anfangskonzentration und die Anzahl der Halbwertszeit
Gefragt nach: Halbwertszeit, Endkonzentrationen und prozentuale Vollendung
Eine Verwendung der Gleichung 14.28 die Halbwertszeit der Reaktion zu berechnen.
B Multiply die Anfangskonzentration von 1/2 auf die Leistung zu der Anzahl von entsprechenden Halbwertzeiten der verbleibenden Konzentrationen nach dieser Halbwertszeit zu erhalten.
C die restliche Konzentration von der Anfangskonzentration subtrahieren. Dann teilen durch die anfängliche Konzentration, um 100 den Anteil Multiplizieren der prozentualen Vollendung zu erhalten.
A Wir können die Halbwertszeit der Reaktion berechnen unter Verwendung der Gleichung 14.28:
Somit dauert es fast 8 Stunden für die Hälfte der Cisplatin zu hydrolysieren.
B Nach 5 Halbwertzeiten (ca. 38 h), wird die verbleibende Konzentration von Cisplatin, wie folgt:
Nach 10-Halbwertszeit (77 h), wird die verbleibende Konzentration von Cisplatin, wie folgt:
C Die prozentuale Fertigstellung nach 5 Halbwertszeit wird wie folgt sein:
Die prozentuale Fertigstellung nach 10 Halbwertszeit wird wie folgt sein:
Somit wird eine erste Ordnung chemische Reaktion beträgt 97% vollständig nach 5 Halbwertzeiten und 100% vollständig nach 10 Halbwertzeiten.
Die Aktivität wird in der Regel in Zerfälle pro Sekunde (dps) oder Zerfälle pro Minute (dpm) gemessen.
Die Aktivität einer Probe wird auf die Anzahl der Atome des radioaktiven Isotops in der Probe direkt proportional:
Tabelle 14.6 Half-Leben und Anwendungen von einigen radioaktiven Isotopen
Radioisotopen-Datingtechniken
Abbildung 14.18 Radiokohlenstoffdatierung
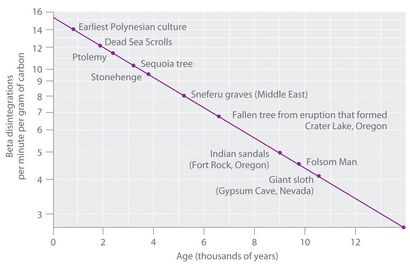
Eine graphische Darstellung der spezifischen Aktivität von 14 C gegen das Alter für eine Anzahl von Proben zeigt eine Ausgrabungs inverse lineare Beziehung zwischen der 14-C-Gehalt (a log-Skala) und Alter (lineare Skala).
Beispiel 11
Gegeben: Isotop und letzte Aktivität
Gefragt nach: verstrichene Zeit
Eine Verwendung der Gleichung 14,30 bis N0 / N zu berechnen. Dann ersetzen Sie den Wert für die Halbwertszeit von 14 C in Gleichung 14.28 die Geschwindigkeitskonstante für die Reaktion zu finden.
B Unter Verwendung der erhaltenen Werte für N0 / N und der Geschwindigkeitskonstante lösen Gleichung 14,32 die verstrichene Zeit zu erhalten.
A Aus Gleichung 14.30. Wir wissen, dass A = kN. Wir können daher die ersten und letzten Aktivitäten (A0 = 15 und A = dpm 8,0 dpm) verwenden, um N0 / N zu berechnen:
A 0 A = k N k 0 N = N 0 N = 15 8,0
Jetzt brauchen wir nur die Geschwindigkeitskonstante für die Reaktion von seiner Halbwertszeit zu berechnen (5730 Jahre) unter Verwendung der Gleichung 14.28:
Diese Gleichung kann umgestellt werden, wie folgt:
B Durch Einsetzen in die Gleichung für t,
Aus unseren Berechnungen, starb der Mann 5200 yr vor.
Die zentralen Thesen
- Die Halbwertszeit einer Reaktion erster Ordnung ist, unabhängig von der Konzentration der Reaktanten ab.
- Die Halbwertszeit der radioaktiven Isotope können bisher Objekte verwendet werden.
Key Gleichungen
Halbwertszeit von Reaktion erster Ordnung