Übersättigte Salzlösung, wie man
Erhöhte Temperatur steigt in der Regel die Löslichkeit von Feststoffen in Flüssigkeiten. Um zu verstehen, warum, müssen wir das zweite Gesetz der Thermodynamik zurückzukehren. Erhöhte Temperatur bedeutet eine größere Durchschnittsgeschwindigkeit für die Partikel. Dies ermöglicht ihnen, von einer Position zur anderen leichter zu bewegen. Die größere Bewegungsfreiheit ermöglicht es das System seinen Zustand leichter zu ändern, und mit dem Zweiten Gesetz zu halten, ändert es den wahrscheinlichsten Zustand zur Verfügung, das heißt, den meist verteilten Zustand, von denen es in der Lage ist. Die Feststoffe werden Systeme kondensiert, so dass die Auflösung eines festen führt in der Regel zu einer erhöhten Streuung des Systems. Daher wird, obwohl es Ausnahmen gibt, führt eine Erhöhung der Temperatur in der Regel zu einer Erhöhung der Löslichkeit eines festen. Die nachfolgende Tabelle zeigt die Änderung in der Löslichkeit mit der Temperatur für Glucose in Wasser zu verändern.
Die Löslichkeit von Glucose
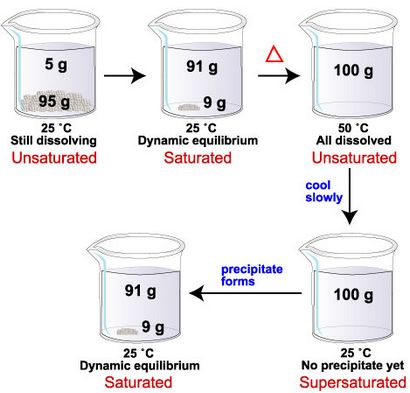
Die Änderung der Löslichkeit mit Änderung der Temperatur kann verwendet werden, um Lösungen mit gelösten mehr gelösten Stoffe zu schaffen als durch die Löslichkeit der Substanz vorhergesagt wird. Zum Beispiel ist die Löslichkeit von Glucose bei 25 ° C 91 g Glucose pro 100 ml Wasser zugegeben, und die Löslichkeit von Glucose bei 50 ° C wird 244 g Glucose pro 100 ml Wasser. Deshalb, wenn man bei 25 ° C auf 100 ml Wasser 100 g Glucose hinzuzufügen, 91 g aufzulösen. Neun Gramm Feststoff verbleibt auf dem Boden, und die Lösung wird bei dieser Temperatur gesättigt. Wenn wir dann die Mischung auf 50 ° C erwärmen, werden die restlichen 9 Gramm Glukose aufzulösen. Bei der neuen Temperatur, die Löslichkeitsgrenze in 100 ml Wasser 244 g Glucose. Mit nur 100 g Glucose gelöst, ist unser System jetzt ungesättigt.
Wenn wir nun langsam die Mischung auf 25 ° C, 9 g Glucose sollte aus der Lösung ausfallen abkühlen zurück. Manchmal geschieht dies sofort, aber manchmal dauert es eine Weile für die Glucosemoleküle ihre Positionen in einer festen Struktur zu finden. In der Zeit zwischen der Abkühlung der Lösung und der Bildung von Glucosekristalle, weist das System eine höhere Menge an gelöstem Glucose (100 g) als durch die Löslichkeitsgrenze bei 25 ° C (91 Gramm) vorhergesagt wird. Da die Lösung mehr gelösten Stoff enthält, als durch die Löslichkeitsgrenze vorhergesagt wird, sagen wir die Lösung übersättigt ist.
Kandiszucker wird aus einer übersättigten Lösung von Zucker hergestellt. Man kann es, indem sie mehr Zucker zu Wasser zugegeben wird, als bei Raumtemperatur auflösen, Erhitzen der Mischung, bis die Löslichkeitsgrenze genug erhöht wurde der gesamte Zucker zu ermöglichen, sich aufzulösen, eine Zeichenfolge in der heißen Lösung suspendiert und so dass die Lösung langsam wieder auf Raumtemperatur abkühlen lassen. Die Lösung bleibt übersättigt für eine lange Zeit. Zuckermoleküle, die relativ groß sind, sind langsam, um die richtigen Positionen für die Kristallbildung zu finden. Inzwischen Kollisionen mit Wassermolekülen sie auseinander halten zu klopfen. Schließlich jedoch feste beginnt mit den geschützten, unregelmäßigen Oberflächen der abgehängten Zeichenfolge zu bilden. Gelöster Zuckermoleküle kollidieren mit dem festen Fällungs auf die Saite, und erstellen Sie nach und nach dem großen, gut gebildeten Zuckerkristalle, die wir Kandiszucker nennen.