Wie eine übersättigte Lösung vorbereiten
Unabhängige Variable:
Temperatur
Abhängige Variable: Grad der Kristallisation
Regelgrößen: Art des Behälters, die Menge an Natriumacetat, Wassermenge
Es ist ein kalter Tag draußen und Sie haben gerade innen kommen, um einige heiße Schokolade zu machen. Wenn Sie die Schokoladenpulver in die kalte Milch gießen, sitzt das Pulver meist nur an der Spitze. Versuchen Sie, wie Sie vielleicht können Sie nicht scheinen, das Pulver zu machen lösen, bis Sie die Milch erwärmen.
Dieser Prozess eines gelösten Stoffes in einer Lösung aufgelöst wird, die Löslichkeit genannt. und wie Sie bei der Herstellung der heiße Schokolade sehen kann, wird durch die Temperatur beeinflusst. Wenn Sie möchten, auf die Löslichkeit lesen, lesen Sie in dieser Lektion: Löslichkeit in der Chemie: Definition - Eigenschaften.
Unser Ziel wird es sein, um zu bestimmen, welche Temperatur für die größte Löslichkeit ermöglicht. Wenn Sie Löslichkeit genug erhöhen können, können Sie eine übersättigte Lösung machen. eine Lösung, die mehr gelösten Stoff als das, was normalerweise hält, gelöst werden. Um dies zu tun, werden wir eine Lösung von Natriumacetat und Wasser zu schaffen. Wenn die Lösung übersättigt, tritt Kristallisation, die der Prozess des gelösten Moleküls Bindung zusammen in der Lösung ist. Wenn wir Kristallisation in unseren Proben sehen, wissen wir die Lösung übersättigt ist.
Wenn Sie zum ersten Mal auf übersättigte Lösungen auffrischen müssen, lesen Sie in dieser Lektion: Übersättigte Lösung: Definition - Beispiel. Bevor Sie beginnen, darüber nachzudenken, was Temperatur, Kälte, Raumtemperatur oder warm, die größte Löslichkeit schaffen würde und somit eine übersättigte Lösung.
- 485 Gramm (g), Natriumacetat
- Waage zum wiegen Natriumacetatpuffer
- 90 Milliliter (ml) Wasser
- 3 500 ml Glasflaschen
- Meßzylinder
- Herdplatte oder Herd
- Kühlschrank
- Handschuhe
- Ofenhandschuhe
- Parafilm
- Thermometer
- Datentabelle:
Temperatur (° C)
1. Zuerst Etikett einen Kolben ‚kalt‘, ein ‚Raumtemp‘ und eine ‚heiße‘.
2. Messen Sie 30 ml Wasser und gießen Sie sie in den ‚Raumtemperatur‘ Kolben.
3.e Messen 30 ml Wasser und gießt es in die ‚kalten‘ Kolben. Setzen Sie den Kolben in den Kühlschrank stellen sie kühl zu halten.
Sicherheits-Spitze. Benutzen Sie Ofenhandschuhe und viel Vorsicht bei Flüssigkeiten sieden. Holen Sie sich einen Erwachsenen zu helfen.
4. Gießen das zuletzt 30 ml Wasser in den ‚heißen‘ Kolben. Hitze auf dem Herd oder Heizplatte, bis es zu kochen beginnt. Vom Herd nehmen.
5. Nehmen Sie die Temperatur von jedem der Kolben und notieren Sie diese in Ihrer Datentabelle.
6. Nun, gieße vorsichtig 160 g Natriumacetat in jeden Kolben. Vorsichtig schwenkt bei dem Versuch, die gesamten Natrium-Acetat zu lösen.
7. Abdeckung jeder Kolben mit Parafilm und ermöglichen ihnen, Raumtemperatur zu erreichen.
8. Wenn alle Kolben die gleiche Temperatur, fallen Kristalle sorgfältig 1-2 Natriumacetat in jedem Kolben. zur Kristallisation beobachten und Ihre Beobachtungen in der Datentabelle aufzunehmen.
Übersättigte Lösung Ergebnisse
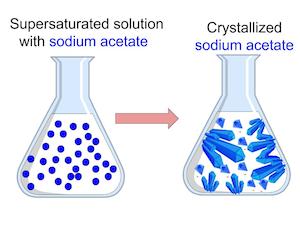
Fehlerbehebung
Schalte Inhalt
Mehr als 55.000 Stunden in allen wichtigen Themen
KOSTENLOSER Zugriff für 5 Tage,
nur ein Konto erstellen.
Keine Verpflichtung, jederzeit kündbar.
Diskussionsfragen
Welche Lösung wurde übersättigt? Woher wusstest du das?
Wie hat Temperatur Löslichkeit beeinflussen?
Wie es funktioniert
Wenn Moleküle sind heißer, gewinnen sie mehr Wärmeenergie von der Wärmequelle und beginnen sie schneller zu bewegen. Die Moleküle auch weiter gespreizt aufgrund ihrer Bewegung. Wenn Moleküle kalt werden, verlieren sie thermische Energie und langsamer bewegen, was auch bewirkt, dass sie zusammen packen. Weitere Informationen über die Temperatur und die molekulare Bewegung, können Sie diese Lektion lesen: Was ist die Temperatur? - Definition - Messung.
Moleküle bewegen sich schneller und verteilt bei höheren Temperaturen
Wenn eine Lösung, erhitzt wird, wie unser Wasser und Natriumacetat, spreizen sich die Lösungsmittelmoleküle aus. Also, unsere Warmwassermoleküle haben mehr Raum zwischen ihnen als das kalte Wasser. Da es mehr Raum zwischen den Wassermolekülen ist, gibt es mehr Platz für die Natriumacetat Moleküle gelöst zu bleiben. Wenn also eine Lösung erhitzt wird, kann es mehr solute halten.
Hotter Lösungen können mehr solute halten
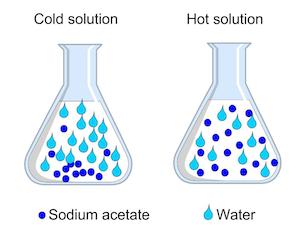
Dies ist der Schlüssel für eine übersättigte Lösung. Übersättigte Lösungen halten mehr gelösten Stoff, als sie normalerweise könnte, wie unser heißes Wasser. Wenn die Lösung abkühlt, werden die Lösungsmittelmoleküle wieder zusammen, die Natriumacetat Verdrängung. Das Natriumacetat sucht nach irgendwohin zu gehen. Wenn Sie am Ende in den beiden Kristallen fiel, hielt sich das überschüssige Natriumacetat in der Lösung zu ihnen, was eine schnelle Bildung von Kristallen aufgefordert. Die Kristallisation ist charakteristisch für übersättigten Lösungen, wenn sie abkühlen.
Um diese Lektion entsperren Sie ein Study.com Mitglied sein muss.
Erstelle deinen Account
Earning College-Kredit
Wussten Sie schon ... Wir haben mehr als 95 College-Kurse, die Sie Kredit von Prüfung zu verdienen vorbereiten, die von mehr als 2.000 Hochschulen und Universitäten akzeptiert wird. Sie können aus den ersten zwei Jahren College testen und Tausende von Ihrem Grad sparen. Jeder kann Kredit-by-Prüfung unabhängig von Alter oder Bildungsniveau verdient.
Übertragen von Kredit an die Schule Ihrer Wahl
Nicht sicher, welche Hochschule Sie noch teilnehmen möchten? Study.com hat Tausende von Artikeln über jeden erdenklichen Grad, Studienbereich und Karriereweg, dass Sie die Schule helfen können, finden die für Sie richtig ist.
Research Schools, Grad - Karriere
Holen Sie sich die unvoreingenommenen Informationen, die Sie die richtige Schule finden müssen.