Die Berechnung formale Ladung Definition & Formula - Video & Lektion Transcript
Es ist wichtig zu wissen, was die Valenzelektrons Beitrag jedes Atom in einem Molekül ist. Um dies zu bestimmen, berechnen wir die formale Ladung der Atome. In dieser Lektion werden wir besprechen, wie formale Ladung zu bestimmen.
Was ist formale Ladung?
Wir können bestimmen, was die Elektronenverteilung im Moleküle durch die formale Ladung herauszufinden. Die formale Ladung ist die Ladung eines Atoms in einem Molekül. Durch die Zugabe von all den formalen Ladungen aller Atome im Molekül, können Sie bestimmen, ob die Gesamtladung des Moleküls positiv, negativ oder neutral. Die Art und Weise der formale Ladung zu bestimmen, ist durch die folgende Gleichung:

Lewis-Struktur
Zu visualisieren, was die Formel sagt, werden wir bei der Lewis-Struktur zunächst einen Blick. Das ist eine Zeichnung des Moleküls, das alle bindenden und nichtbindenden Elektronen zeigt. Schauen wir uns das Beispiel des Kohlendioxid-Lewis-Struktur einen Blick gezeigt (Video sehen). Die Lewis-Struktur von Kohlendioxid zeigt, dass, wenn wir sagen Bindungselektronen. wir müssen die Linien auf der Struktur zählen. Eine Zeile entspricht zwei Elektronen. Die nichtbindender Elektronen. auf der anderen Seite sind die ungeteilten Elektronen. Diese werden als Punkte dargestellt. Ein Punkt entspricht einem nichtbindender Elektronen. Die Valenzelektronen sind die Elektronen auf der äußersten Schale des Atoms.
Valenzelektronen
Lassen Sie sich eine einfache Art und Weise erinnern Valenzelektronen auf ihrer Gruppennummer im Periodensystem auf Basis zu zählen. Es ist ein Muster, zum Zählen von Valenzelektronen auf der Grundlage der Gruppennummer ein Atom aufweist. So ist beispielsweise Natrium (Na) in der Gruppe 1, also hat er 1 Valenzelektronen. Sauerstoff (O) ist in der Gruppe 16, daher hat sie 6 Valenzelektronen. Brom (Br) ist in der Gruppe 17, so hat es 7 Valenzelektronen. Eine Ausnahme, die wir zur Kenntnis nehmen müssen, ist für Helium (He). Es ist in der Gruppe 18; Es hat sich jedoch nur 2 Valenzelektronen, weil die maximale Anzahl von Elektronen ist 2. Alle anderen Edelgasen in der Gruppe 18, wie beispielsweise Neon (Ne), Argon (Ar), und der Rest, haben 8 Valenzelektronen. Wir verließen aus Gruppen 3-12. Das ist, weil kein Muster für die Valenzelektronen für diese Elemente vorhanden ist, und es ist eine andere und komplexere Art und Weise ihrer Valenzelektronen zu zählen.
Schritt-für-Schritt-Verfahren
Nachdem wir nun die Formel für die Bestimmung der formale Ladung wissen, lassen Sie uns dies in die Praxis umzusetzen und gehen darüber, wie die formale Ladung für jedes Atom in einem Molekül Schritt für Schritt zu bestimmen. Die Formel für die formale Ladung ist:
Lassen Sie uns mit etwas Einfaches, wie Kohlendioxid beginnen. Kohlendioxid hat ein Kohlenstoffatom und zwei Sauerstoffatome. Seine Lewis-Struktur sieht wie folgt aus:
Schritt 1: Berechne die formale Ladung von C
Kohlenstoff (C) ist in der Gruppe 14, so dass heißt, es hat 4 Valenzelektronen. Es gibt keine Punkte um Kohlenstoff, so dass heißt, es keine nichtbindender Elektronen hat. Es gibt 4 Linien um Kohlenstoff und eine Linie ist gleich zwei Bindungselektronen. Kohlenstoff hat daher 8 Bindungselektronen.
VE gleich 4
NE gleich 0
BE gleich 8
Wir ersetzen nun die Werte, und wir haben:
formale Ladung = 4-0 - 8/2 = 0
Die formale Ladung von Kohlenstoff ist 0.
Schritt 2: Berechnen Sie die formale Ladung von Sauerstoff auf der Linken
Sauerstoff (O) ist in der Gruppe 16, so bedeutet dies, daß 6 Valenzelektronen. Es gibt 4 Punkte um Sauerstoff, so dass es bedeutet, 4 nichtbindender Elektronen hat es sind 2 Zeilen zu Sauerstoff gebunden und eine Zeile ist gleich zwei Bindungselektronen. Sauerstoff hat daher 4 Bindungselektronen.
VE gleich 6
NE gleich 4
BE gleich 4
Wir ersetzen nun die Werte, und wir haben:
formale Ladung = 6-4 - 4/2 = 0
Die formale Ladung von Sauerstoff (links) ist 0.
Schritt 3: Berechnen Sie die formale Ladung von Sauerstoff auf der rechten
Sauerstoff (O) ist in der Gruppe 16, so bedeutet dies, daß 6 Valenzelektronen. Es gibt 4 Punkte um Sauerstoff, so dass heißt, es 4 nichtbindender Elektronen hat. Es gibt 2 Linien Sauerstoff gebunden, und eine Leitung ist gleich zwei Bindungselektronen. Sauerstoff hat daher 4 Bindungselektronen.
VE gleich 6
NE gleich 4
BE gleich 4
Wir ersetzen nun die Werte, und wir haben:
Die formale Ladung von Sauerstoff (rechts) gleich 0 ist.
Schritt 4: Überprüfen Sie die Gesamtladung
Schalte Inhalt
Mehr als 55.000 Stunden in allen wichtigen Themen
KOSTENLOSER Zugriff für 5 Tage,
nur ein Konto erstellen.
Keine Verpflichtung, jederzeit kündbar.
Wählen Sie ein Thema, um eine Vorschau im Zusammenhang Kurse:
Nun fügen wir alle der formalen Ladungen der Atome in dem Kohlendioxid-Molekül. Die Tatsache, daß Kohlendioxid keinen oberen Index hat, der zum Laden bezieht, bedeutet, dass die Gesamtladung gleich Null sein sollte. Lassen Sie uns überprüfen (siehe Video). Alle formalen Ladungen sind gleich Null. Wenn wir sie alle, fügen Sie die Summe gleich Null sein. Wir wissen, daß Kohlendioxid ein neutrales Molekül ist, das seine Gesamtladung bedeutet Null ist. Wir haben gerade bestätigt dies, indem alle der formalen Ladungen zusammen und bekommen eine Summe zu berechnen, die gleich Null ist. Die Werte stimmen, was bedeutet, dass wir es richtig gemacht haben.
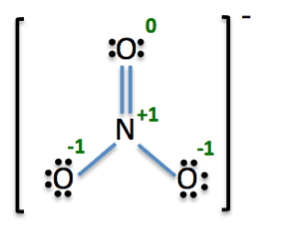
Betrachten wir ein anderes Beispiel. Lassen Sie uns die negativ geladenen Nitrationen suchen. Das negative Vorzeichen auf der rechten oberen Seite der Lewis-Struktur bedeutet, dass die Gesamtladung -1 (siehe Video). Lassen Sie uns die formalen Ladungen des Stickstoffs und die drei Sauerstoffatome finden. Wir werden uns Sauerstoff mit einer Nummer in roten Etikett (siehe Video). Jetzt können wir die formalen Ladungen für alle Atome im Molekül Nitrat berechnen:
Stickstoff:
Stickstoff (N) ist in der Gruppe 15, so hat es 5 Valenzelektronen (VE). Es gibt vier Leitungen herum, so hat es 8 Bindungselektronen (BE), und es gibt keine Punkte um sie herum, so gibt es keine nichtbindenden Elektronen (NE).
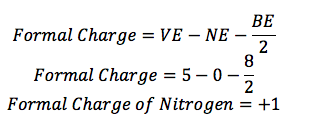
Sauerstoff 1:
Sauerstoff (O) ist in der Gruppe 16, so hat es 6 Valenzelektronen (VE). Es gibt 2 Zeilen mit ihm verbunden, so hat es 4 Bindungselektronen (BE), und es gibt 4 Punkte um ihn herum, so gibt es 4 nichtbindenden Elektronen (NE).
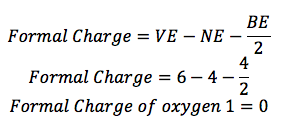
Sauerstoff 2:
Sauerstoff (O) ist in der Gruppe 16, so hat es 6 Valenzelektronen (VE). Es gibt 1 Linie mit ihm verbunden, so hat es 2 Bindungselektronen (BE), und es gibt 6 Punkte um ihn herum, so gibt es 6 nichtbindenden Elektronen (NE).
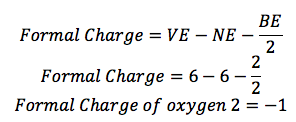
Oxygen 3:
Sauerstoff (O) ist in der Gruppe 16, so hat es 6 Valenzelektronen (VE). Es gibt 1 Linie mit ihm verbunden, so hat es 2 Bindungselektronen (BE), und es gibt 6 Punkte um ihn herum, so gibt es 6 nichtbindenden Elektronen (NE).
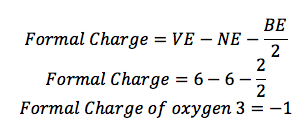
Gesamtgebühr:
Nun fügen wir alle der formalen Ladungen:
Die Gesamtladung ist gleich -1. Dies stimmt mit der korrekten Gesamtladung von Nitrationen. Das gibt uns einen guten Tipp, wenn unsere Berechnungen korrekt sind.
Lassen Sie uns überprüfen. Die formale Ladung berechnet die einzelnen Ladung eines Atoms in einem Molekül. Dies zeigt an, ob das Atom hat eine positive, negative oder neutrale Ladung. Die formale Ladung wird durch die Valenzelektronen (VE), nichtbindenden Elektronen (NE) und Bindungselektronen (BE) in der folgenden Formel bestimmt:
Durch die Berechnung der formalen Ladung jedes Atom in einem Molekül, können wir die Gesamtladung des Moleküls bestimmen.
Earning College-Kredit
Wussten Sie schon ... Wir haben mehr als 95 College-Kurse, die Sie Kredit von Prüfung zu verdienen vorbereiten, die von mehr als 2.000 Hochschulen und Universitäten akzeptiert wird. Sie können aus den ersten zwei Jahren College testen und Tausende von Ihrem Grad sparen. Jeder kann Kredit-by-Prüfung unabhängig von Alter oder Bildungsniveau verdient.
Übertragen von Kredit an die Schule Ihrer Wahl
Nicht sicher, welche Hochschule Sie noch teilnehmen möchten? Study.com hat Tausende von Artikeln über jeden erdenklichen Grad, Studienbereich und Karriereweg, dass Sie die Schule helfen können, finden die für Sie richtig ist.
Research Schools, Grad - Karriere
Holen Sie sich die unvoreingenommenen Informationen, die Sie die richtige Schule finden müssen.