Allgemeine Chemie
Wikipedia hat verwandte Informationen zu Precipitation (Chemie)
Eine Fällungsreaktion tritt auf, wenn eine ionische Substanz aus der Lösung kommt und bildet einen unlöslichen (oder leicht löslich) Feststoff. Der Feststoff, der aus der Lösung kommt, ist ein Niederschlag genannt. Dies kann auftreten, wenn zwei lösliche Salz (ionische Verbindungen) werden gemischt und einen unlöslichen einen den Niederschlag bilden.
Ein Beispiel ist das Bleinitrat mit Kaliumiodid gemischt, was einen hellgelbe Niederschlag von Bleiiodid bildet.
Man beachte, dass der Bleiiodid als ein Feststoff gebildet wird. Die vorhergehende Gleichung wird in der molekularen Form geschrieben, die der Beschreibung der Reaktion nicht der beste Weg ist. Jedes der Elemente wirklich existieren in Lösung als einzelne Ionen, nicht aneinander gebunden sind (wie in Kaliumjodid Kristalle). Wenn wir die oben als ionische Gleichung schreiben. wir bekommen eine viel bessere Vorstellung von dem, was tatsächlich geschieht.
Beachten Sie die ähnliche Ausdrücke auf beiden Seiten der Gleichung. Diese werden Zuschauer Ionen genannt, weil sie nicht an der Reaktion teilnehmen. Sie können ignoriert werden, und die Nettoionengleichung geschrieben wird.
In der Lösung gibt es sowohl Blei und Iodid-Ionen. Da Bleiiodid unlöslich, sie spontan kristallisieren und den Niederschlag bilden.
Säure-Base-Neutralisierungs bearbeiten
In einfachen Worten, ist eine Säure, eine Substanz, die einen H + -Ion (d.h. ein Proton) und eine Base ist eine Substanz, verlieren kann, die ein Proton aufnehmen können. Wenn gleiche Mengen einer Säure und Base reagieren, neutralisieren sie sich gegenseitig, bildende Spezies, die nicht als sauer oder basisch ist.
Wenn beispielsweise Salzsäure und Natriumhydroxid reagieren, bilden sie Wasser und Natriumchlorid (Kochsalz).
Auch hier erhalten wir ein klareres Bild von dem, was passiert, wenn wir eine Nettoionengleichung schreiben.
Säure-Base-Reaktionen passieren oft in wässriger Lösung, aber sie können auch in gasförmigem Zustand auftreten. Säuren und Basen werden in viel ausführlicher in den Säuren und Basen Abschnitt erörtert. die Reaktion
Die Verbrennung von Methan (Abgabe von Wärme und Licht)
Verbrennung, besser als Verbrennung bekannt ist, ist die Kombination aus einer Substanz mit Sauerstoff. Die Produkte sind Kohlendioxid, Wasser und mögliche andere Abfallprodukte. Verbrennungsreaktionen setzen große Mengen an Wärme. C3 H8. besser als Propan bekannt, die Verbrennung unterzogen wird. Die ausgeglichene Gleichung lautet:
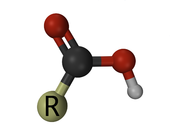
Dies ist Carbonsäure. Alle funktionellen Gruppen Ende mit einem „R“ -a Platzhalter für den Rest des Moleküls.
Organische Reaktionen treten zwischen organischen Molekülen (Moleküle, die Kohlenstoff und Wasserstoff). Da es eine praktisch unbegrenzte Anzahl von organischen Molekülen ist, ist der Umfang der organischen Reaktionen sehr groß. Jedoch sind viele der Eigenschaften von organischen Molekülen durch funktionelle Gruppen -small Atomgruppen bestimmt, die in vorhersehbarer Weise reagieren.
Ein weiteres wichtiges Konzept in organischen Reaktionen ist Lewis-Basizität. Teile von organischen Molekülen können elektrophilen (elektronenliebenden) oder nucleophile (Kern oder positive liebend) sein. Nukleophile Regionen haben einen Überschuß an Elektronen-wirken sie als Lewis-Basen-Bereiche während elektrophilen Elektronenmangel sind und wirken als Lewis-Säuren. Die nukleophilen und elektrophile Regionen anziehen und miteinander reagieren. Organische Reaktionen sind über den Rahmen dieses Buches, und werden ausführlicher in der Organischen Chemie abgedeckt. Allerdings können die meisten organischen Substanzen Ersatz Reaktionen und Verbrennungsreaktionen eingehen, wie Sie bereits gelernt haben.
Die Bildung von Fluorwasserstoff aus den Elementen erfordert Reduktion von Fluor und Oxidation von Wasserstoff.
Redox ist eine Abkürzung von Reduktions- / Oxidationsreaktionen. Dies ist genau das, was in einer Redox-Reaktion der Fall ist, eine Spezies reduziert wird und eine andere oxidiert wird. Reduktion beinhaltet einen Gewinn von Elektronen und Oxidation einen Verlust, so dass eine Redoxreaktion ist ein, in den Elektronen zwischen den Arten übertragen werden. Reaktionen, bei denen etwas „verbrannt“ (Brennmittel oxidiert zu werden) sind Beispiele von Redox-Reaktionen, aber auch Oxidationsreaktionen in Lösung auftreten, was sehr nützlich ist, und bildet die Basis der Elektrochemie.
Redox-Reaktionen werden als zwei Halbreaktionen, welche die Reduktions- und Oxidationsprozesse separat oft geschrieben. Diese Halbreaktionen ausgeglichen sind (von jeweils mit einem Koeffizienten multipliziert wird), und addiert, um die vollständige Gleichung zu bilden. Wenn Magnesium in Sauerstoff verbrannt wird, verliert es Elektronen (es wird oxidiert). Im Gegensatz dazu die Sauerstoff Gewinne Elektronen aus dem Magnesium (werden reduziert).
Redoxreaktionen wird ausführlicher in dem Redox-Abschnitt erörtert werden.